Review Nguyên tử nhận thêm 2 electron thì trở thành
Kinh Nghiệm Hướng dẫn Nguyên tử nhận thêm 2 electron thì trở thành Mới Nhất
Bùi Đàm Mai Phương đang tìm kiếm từ khóa Nguyên tử nhận thêm 2 electron thì trở thành được Cập Nhật vào lúc : 2022-11-17 07:52:03 . Với phương châm chia sẻ Thủ Thuật Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi đọc Post vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Mình lý giải và hướng dẫn lại nha.Nội dung chính Show
- Câu hỏi tiên tiến nhất Câu hỏi tiên tiến nhất

Nếu nguyên tử đang thừa –1,6.10-19 C điện lượng mà nó nhận được thêm 2 electron thì nó. A. sẽ là ion dương. B. vẫn là một trong ion âm. C. trung hoà về điện.
Xem rõ ràng »

Khi một nguyên tử nhận thêm electron hay nhường bớt electron, nó trở thành ion. Mô hình sau màn biểu diễn nguyên tử liti, nguyên tử nito và ion trong hợp chất liti ...
Xem rõ ràng »

10 thg 5, 2022 · Nguyên tử trung hòa về điện, khi nhận thêm electron sẽ trở thành : A. Ion –. B. Ion +. C. Không xác định được. D. Không có gì thay đổi.
Xem rõ ràng »

Nếu nguyên tử đang thừa – 1,6.10-19 C điện lượng mà nó nhận được thêm 2 electron thì nó. A. vẫn là một trong ion âm. B. trung hoà về điện. C. sẽ là ion dương.
Xem rõ ràng »

Giải thích tiến trình giải: Khi nguyên tử nhận thêm hay bỏ ra một số trong những electron thì số proton không hề bằng số electron nữa, nghĩa là số điện tích ...
Xem rõ ràng »

4/ Nếu nguyên tử đang thừa – 1,6.10-19 C điện lượng mà nó nhận được thêm 2 electron thì nó. Bài 2: Thuyết Electron và định luật bảo toàn điện tích.
Xem rõ ràng »

Nếu nguyên tử đang thừa – 1,6.10-19 C điện lượng mà nó nhận được thêm 2 electron thì nó.
Xem rõ ràng »

Xếp hạng 4,5 (1.171) Câu 2: Công thức liên hệ giữa số lượng giới hạn quang điện , công thoát electron A của sắt kẽm kim loại, hằng số Planck h và tốc độ ánh sáng trong chân không c ...
Xem rõ ràng »

Nguyên tử trung hòa về điện, khi nhận thêm electron sẽ trở thành: a. Ion-. b. Ion ...
Xem rõ ràng »

B. vẫn là một trong ion âm. C. trung hoà về điện. D. có điện tích không xác định được. Đáp án B. Nếu nguyên tử ...
Xem rõ ràng »

Nếu nguyên tử đang thừa – 1,6.10-19 C điện lượng mà nó nhận được thêm 2 electron thì nó. A. sẽ là ion dương. B. vẫn là một trong ion âm. C. trung hoà về điện.
Xem rõ ràng »

Nếu nguyên tử đang thừa – 1,6.10-19 C điện lượng mà nó nhận được thêm 2 electron thì nóHỗ trợ học tập, giải bài tập, tài liệu miễn phí Toán học, Soạn văn, ...
Xem rõ ràng »

Tác giả: kinhcan - Nhận 205 ... nó nhận được thêm 2 electron thì nó.
Xem rõ ràng »

Một nguyên tử trung hòa về điện thì nhận thêm 2 electron. Hỏi lúc: 3 tháng trước. Trả lời: 0. Lượt xem: 61. You are using an out of date browser.
Xem rõ ràng »

Câu hỏi: Nếu nguyên tử đang thừa – 1,6.10-19 C điện lượng mà nó nhận được thêm 2 electron thì nó. A sẽ là ion dương. B vẫn là một trong ion âm. C trung hoà về điện.
Xem rõ ràng »
Câu hỏi tiên tiến nhất
Xem thêm »










Câu hỏi tiên tiến nhất
Xem thêm »










I. SỰ HÌNH THÀNH ION, CATION, ANION
1. Ion, cation, anion
a) Sự tạo thành ion
- Nguyên tử luôn trung hòa về điện, nhưng khi nguyên tử nhường hay nhận thêm electron thì nó trở thành phần tử mang điện gọi là ion.
b) Sự tạo thành cation
- Thí dụ: Sự hình thành cation của nguyên tử $Li,(Z=3)$
Cấu hình $e$: $1s^2,,2s^1$
$1s^2,,2s^1 ,longrightarrow , 1s^2 ,+, 1e$
Hay: $Li , longrightarrow , Li^+ ,+, 1e$
- Kết luận: Trong những phản ứng hóa học, để đạt được thông số kỹ thuật bền của khí hiếm, nguyên tử sắt kẽm kim loại có khuynh hướng nhường electron lớp ngoài cùng cho nguyên tử những nguyên tố khác để trở thành phần tử mang điện dương gọi là ion dương hay cation.
$ns^1$ nhường $1e,(n>1)$ $longrightarrow$ Ion $M^+$
$ns^2$ nhường $2e,(n>1)$ $longrightarrow$ Ion $M^2+$
$ns^2,,np^1$ nhường $3e$ $longrightarrow$ Ion $M^3+$
$Longrightarrow$ Tên cation được gọi theo tên sắt kẽm kim loại.
Thí dụ: $Li^+$ gọi là $cation,, liti$
c) Sự tạo thành anion
- Thí dụ: Sự hình thành anion của nguyên tử $F,(Z=9)$
Cấu hình $e$: $1s^2,,2s^2,,2p^5$
$1s^2,,2s^2,,2p^5 ,+, 1e ,longrightarrow , 1s^2,,2s^2,,2p^6$
Hay: $F ,+, 1e ,longrightarrow , F^-$
- Kết luận: Trong những phản ứng hóa học, để đạt được thông số kỹ thuật bền của khí hiếm, nguyên tử phi kim có khuynh hướng nhận thêm $e$ của nguyên tử những nguyên tố khác để trở thành phần tử mang điện âm gọi là ion âm hay anion.
$ns^2,,np^3$ nhận $3e$ $longrightarrow$ Ion $X^3-$
$ns^2,,np^4$ nhận $2e$ $longrightarrow$ Ion $X^2-$
$ns^2,,np^5$ nhận $1e$ $longrightarrow$ Ion $X^-$
$Longrightarrow$ Tên anion được gọi theo tên gốc axit (trừ $O_2$ - gọi là anion oxit).
Thí dụ: $F^-$ gọi là $anion,, florua$
2. Ion đơn nguyên tử và ion âm đa nguyên tử
a) Ion đơn nguyên tử
- Ion đơn nguyên tử là những ion tạo nên từ 1 nguyên tử.
- Thí dụ:
+ Cation $Li^+$, $Na^+$, $Mg^2+$, $Al^3+$...
+ Anion $F^-$, $Cl^-$, $S^2-$...
b) Ion đa nguyên tử
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm.
- Thí dụ:
+ Cation amoni $NH_4^+$...
+ Anion hiđroxit $OH^–$, anion sunfat $SO_4^2-$
II. SỰ TẠO THÀNH LIÊN KẾT ION
- Thí dụ: Xét phân tử $NaCl$
+ Nguyên tử $Na$ nhường $1e$ cho nguyên tử $Cl$ để trở thành ion dương $Na^+$.
$Na ,longrightarrow , Na^+ ,+, 1e$
+ Nguyên tử $Cl$ nhận $1e$ từ $Na$ để trở thành ion âm $Cl^-$.
$Cl ,+, 1e ,longrightarrow , Cl^-$
+ Quá trình được màn biểu diễn như sau:
$,,,,,Na ,,,,,+,,,,, Cl ,,,,, longrightarrow ,, Na^+ ,,+,,,,, Cl^- nonumber \ (2,8,1),,,,,,(2,8,7),,,,,,,,,,,,(2,8),,,,,,,,,,(2,8,8)$
+ Hai ion tạo thành $Na^+$ và $Cl^-$ mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử $NaCl$:
$Na^+ ,+, Cl^- ,longrightarrow , NaCl$
+ Phản ứng hóa học trên hoàn toàn có thể màn biểu diễn bằng phương trình hóa học sau:
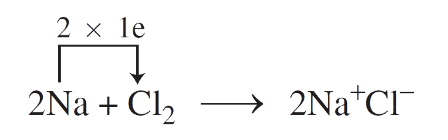
- Kết luận: Liên kết ion là link được hình thành bởi lực hút tĩnh điện Một trong những ion mang điện tích trái dấu.
III. TINH THỂ ION
1. Tinh thể $NaCl$
- Ở thể rắn, $NaCl$ tồn tại dưới dạng tinh thể ion. Trong mạng tinh thể $NaCl$, những ion $Na^+$, $Cl^-$ được phân bố luân phiên đều đặn và có trật tự trên những đỉnh của hình lập phương nhỏ. Xung quanh mỗi ion đều có 6 ion ngược dấu link với nó.
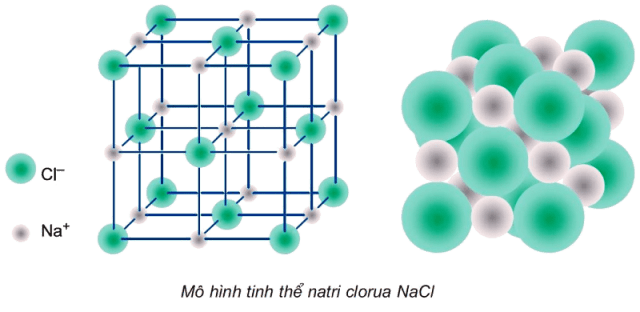
2. Tính chất chung của hợp chất ion
- Tinh thể ion rất bền vững vì lực hút tĩnh điện Một trong những ion ngược dấu trong tinh thể lớn.
- Các hợp chất ion đều khá rắn, khó nóng chảy, khó bay hơi.
- Các hợp chất ion thường tan nhiều trong nước.
- Khi nóng chảy, khi hòa tan trong nước, chúng tạo thành dung dịch dẫn điện. Ở trạng thái rắn, tinh thể ion không dẫn điện.
Page 2
SureLRN
 Tải thêm tài liệu liên quan đến nội dung bài viết Nguyên tử nhận thêm 2 electron thì trở thành
Tải thêm tài liệu liên quan đến nội dung bài viết Nguyên tử nhận thêm 2 electron thì trở thành

Post a Comment